随着细胞和基因治疗的快速发展,病毒被改造成病毒载体作为一种转基因工具,以实现控制目的基因(GOI)转移到所需细胞中。其中,慢病毒的安全性和生产工艺被研究地较为透彻。目前已发展至第三代自失活sin-慢病毒载体,采用四质粒包装系统(Gag-pol\Rev\VSV-G\GOI),不仅删除了致病性病毒元件,还设计△U3-3’LTR,提高了病毒安全性。
VSV-G包膜的慢病毒载体(vesicular stomatitis virus- glycoprotein)是在细胞治疗应用中最常用的慢病毒载体包膜。未假型的野生型慢病毒包膜gp-160,只能感染CD4+T细胞,且有安全性风险。而VSV-G是水泡性口炎病毒,具有诸多优点:
① 安全性更高,感染嗜性广(受体LDL-R低密度脂蛋白受体在大多数细胞膜上有表达);
② 包装滴度高,耐超速离心制备和剪切力。
然而,VSV-G包膜的慢病毒载体对于特定细胞的转染效率较低,如HSCs,NK细胞,且作为体内递送系统会有一些短板:
① 容易被血清快速清除;
② 没有感染特异细胞能力,有安全性风险;
③ 影响体内生物分布,药效等。
为解决以上问题,提高特定细胞的转染效率,科学家进行广泛的异源包膜假型能力研究。以下总结了几点最受关注的问题。
1. 如何选择合适的假型包膜类型?
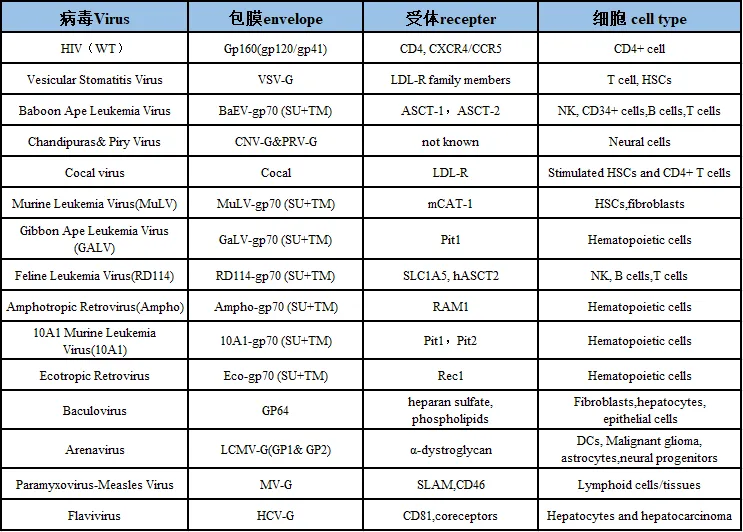
不同的靶细胞类型需要不同的包膜进行高效的转染。以下表格归纳了当前的一些研究进展,具体包括病毒种类、包膜结构、受体(种类和丰度):
表1:不同病毒来源的包膜及其感染倾向性
健新原力团队拥有包膜开发能力,基于病毒包膜设计平台,已开发BaEV、RD114、GaLV、MLV包膜,以适应不同的细胞转染,比如NK细胞、B细胞、T细胞、造血干细胞。此外,还可为客户提供包膜开发和定制业务。
2. 影响包膜假型成功、包装效率高低的关键影响因素是什么?
以逆转录病毒为例,其感染过程:首先,包膜糖蛋白附着在受体上并直接融合到宿主细胞膜上;其次,包膜糖蛋白被病毒蛋白酶切割成两个亚基:表面(SU)和跨膜(TM)。其中SU亚基高度糖基化,这有助于与受体结合。SU受体结合后触发TM蛋白的构象变化,允许外结构域插入宿主细胞膜,实现融合。
TM蛋白由三个结构域组成:N端外结构域、跨膜结构域TM和细胞质尾部。跨膜结构域固定病毒在细胞膜上,而细胞质尾部则与基质蛋白相互作用。
逆转录病毒包膜的组织结构是保守的,但载体与异种包膜糖蛋白的组合并不总是兼容的。这样就可能影响病毒组装,进而影响表达滴度。因此,包膜效率的高低(与异种病毒内核的相容性)取决于包膜胞内尾端的结构改造。比如C末端截断或嵌合的GALV包膜,其慢病毒滴度提高了10^4倍。
3. 健新原力应用案例
NK细胞是已知最有效的杀伤肿瘤细胞的免疫细胞之一,对抑制肿瘤组织的发生、发展和扩散起着重要的作用。而且,NK 细胞可以跨越 HLA 屏障移植而不会引起移植物抗宿主病(GvHD),因此经过基因改造的CAR-NK具有广阔的前景。但是与大量 CAR-T 细胞临床研究相比,CAR-NK 细胞疗法开发明显落后,主要在CMC工艺开发过程存在两方面的瓶颈:1)转导效率相对较低;2)难以对人类原代 NK 细胞进行大规模基因工程改造。
人类 T 细胞可以使用 VSV-G 糖蛋白作为包膜假型轻松通过慢病毒载体转导,而 NK 细胞不能表达足够量的作为VSV-G 的进入受体的 LDL 受体家族细胞表面分子。因此,VSVG包膜假型的慢病毒颗粒不能有效进入NK细胞。
NK细胞中大量表达钠依赖性中性氨基酸转运(ASCT-2)。科学家发现另外两种包膜假型BaEV和RD114均可识别ASCT-2。且相较于RD114,BaEV还能识别ASCT-1,ASCT-1 和 -2 受体具有 57% 相同的序列,这使得 BaEV比RD114具有更广泛的趋向性,更容易进入NK细胞并实现转导。
基于这些研究和发现,健新原力团队利用内部平台构建的慢病毒骨架,优化改造了包膜结构和序列,构建出自己的BaEV-LVV和RD114-LVV慢病毒载体,并进行了病毒上下游工艺开发。
如下图1所展示,实验对比了BaEV-LVV与RD114-LVV分别转导NK细胞的效率,结果发现BaEV-LVV对NK细胞的转染效率更高,可达到74%,因此,BaEV-LVV可作为CAR-NK产品工艺开发中优秀的基因递候选工具之一。
进一步,经过健新原力工艺团队的开发,使用MOI=0.5的BaEV-LVV,可实现更高转染效率(80.1%)(图2),这不仅降低CAR-NK细胞中插入的CD19基因拷贝数(EMA规定≤5 copies/cell),提高病毒的使用安全性,而且还降低了病毒载体的使用成本。
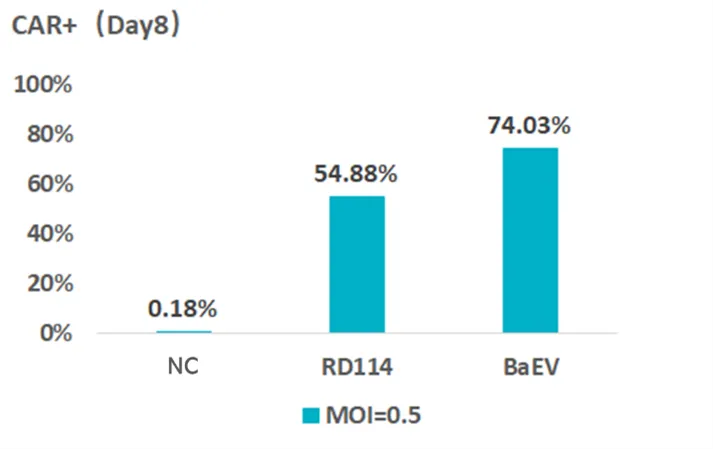
图1 对比RD114和BaEV包膜的慢病毒载体对NK细胞的转染效率
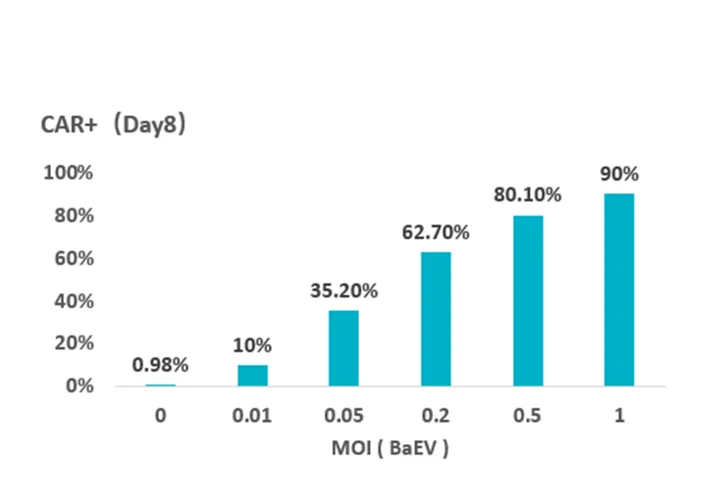
图2 利用不同MOI的BaEV包膜慢病毒载体转染NK细胞
【健新原力慢病毒载体工艺平台】
健新原力病毒载体平台拥有先进的工艺开发实验室和多条灵活设计的GMP生产线,符合临床及商业化阶段生产需求。车间配备多种领先的生产设备,如Pall iCELLis 500+固定床生物反应器, Cytiva WAVE25, XDR-200/500L一次性生物反应器,及细胞工厂,以满足不同病毒载体生产工艺、不同生产规模的需求。
平台可提供FTO(Freedom to Operate)高产的质粒骨架、贴壁及悬浮细胞株,溯源清晰;此外,用于慢病毒载体生产的三个辅助质粒Inno-pLenti™已在FDA CBER备案DMF(Drug Master File, 药物主文件),更高效合规地支持项目申报及GMP生产。
健新原力病毒平台已拥有丰富的慢病毒载体项目及生产经验,过往项目经验实现100%按时交付。同时,健新原力持续积累经验,并为解决更多未满足的需求而持续开发前沿技术,支持客户管线项目创新、快速申报并推进商业化。
中文 


健新原力
Topping 