1. 慢病毒in vivo CAR的应用
目前,全球范围内及中国已上市12款CAR-T细胞疗法,无一例外均是ex vivo CAR-T,也就是需要将自体T细胞在体外经过基因工程改造和扩增培养后,再回输到患者体内的细胞疗法。虽然ex vivo CAR-T在肿瘤治疗效果上取得了颠覆性突破,但其整体生产过程复杂、周期漫长且成本昂贵,一定程度限制了其商业化进程和患者的可及性。
众所周知,慢病毒载体是目前ex vivo CAR-T细胞疗法常用的递送载体,并已经在CMC和临床应用中积累了丰富的经验。因此,它也顺理成章地成为了in vivo CAR-T递送载体的首选,有望助力in vivo CAR-T实现更广泛的临床应用,拓展CAR-T疗法的适用范围,为更多患者带来治疗希望。
In vivo CAR-T vs. ex vivo CAR-T
与传统的ex vivo CAR-T细胞疗法相比,慢病毒in vivo CAR-T细胞疗法在生产周期、安全性和治疗方案上具有显著优势。
首先,in vivo CAR-T疗法省去了体外细胞培养和基因改造的复杂步骤,直接将慢病毒载体注射到患者体内,大大简化了生产流程。这不仅降低了生产成本,还缩短了治疗周期,使患者能够更快地接受治疗。
其次,in vivo CAR-T疗法避免了体外生产过程中可能出现的细胞污染和变异风险,提高了治疗的安全性。
此外,患者不需要接受化疗方案进行清淋,保持完整的免疫系统。慢病毒载体的高滴度和高感染效率也确保足够的T细胞在体内完成基因改造,从而发挥出强大的抗肿瘤效果。
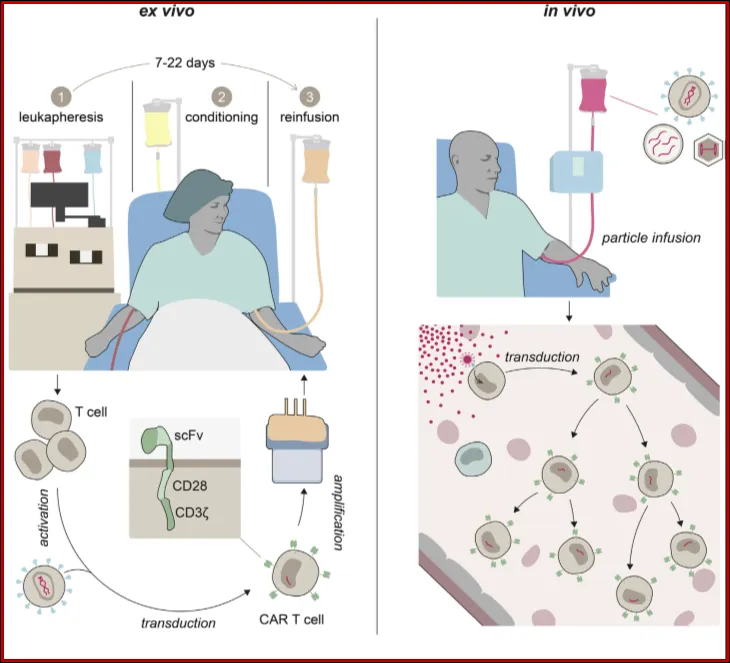
Ex vivo vs. in vivo CAR-T细胞疗法
来源: Mol Ther. 2022 Jul 6;30(7):2401-2415.
2. 全球慢病毒in vivo CAR的技术革新和临床进展
基于以上背景,越来越多的科学家和企业投身于慢病毒in vivo CAR-T的研究和开发,推动该疗法的发展。2024年是in vivo CAR疗法大跨越的一年,目前已有2个in vivo CAR-T项目经过监管批准进入Ⅰ期临床阶段,均是基于慢病毒载体。
2.1 Interius INT2104
Interius公司的主要候选管线INT2104是一种非复制型、自激活的in vivo CAR慢病毒。2024年7月9日,Interius宣布获得澳大利亚治疗用品管理局(TGA)的临床试验批准,开展其在研in vivo CAR-T疗法INT2104的临床1期试验,用以治疗B细胞恶性肿瘤。
INT2104项目研究者将CD7抗体片段嵌入到慢病毒载体中,实现体内同时定向转导T和NK细胞,并生成靶向CD20的CAR-T和CAR-NK细胞,从而杀伤CD20阳性的肿瘤细胞,达到治疗的B细胞恶性肿瘤的目的。

Interius INT2104 in vivo CAR慢病毒管线。来源:Interius
2.2 Umoja UB-VV111
Umoja公司开发了VivoVec平台以实现特异性和高效的体内转导。利用该平台开发的CD19 靶向的in vivo CAR-T细胞疗法UB-VV111已于2024年8月1日获得FDA的IND批件,用以治疗血液恶性肿瘤。
VivoVec平台将CD3抗体和CD58及CD80共刺激域融合表达,显著激活T细胞并提高转导效率。同时,Cocal 融合糖蛋白作为胞膜蛋白,可与宿主细胞低密度脂蛋白受体LDL-R结合,帮助病毒特异性靶向并进入T细胞。
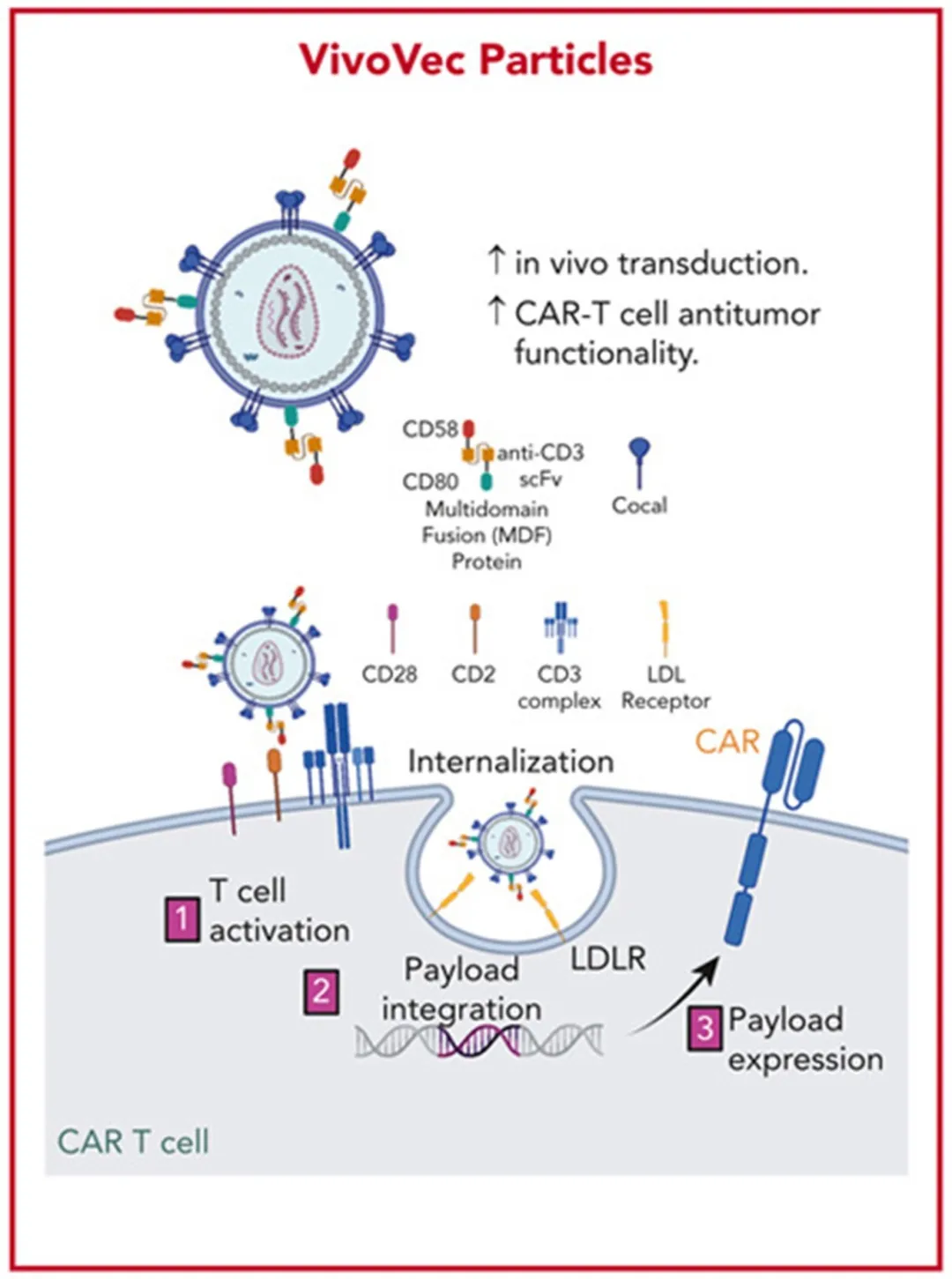
Umoja VivoVec in vivo CAR慢病毒平台。来源:Blood. 2024 Aug 29;144(9):977-987.
2.3 国内进展
国内已有一条慢病毒in vivo CAR-T 管线进入IIT,并在2024年10月公布初步临床结果——靶向CD19 in vivo CAR-T成功治疗急性B淋巴细胞白血病(B-ALL)和弥漫性大B淋巴瘤(DLBCL)两例患者并获得完全缓解,且两例患者治疗过程中均未出现2级及以上细胞因子风暴和神经毒性等CAR-T治疗常见副作用。
由此表明,慢病毒载体递送的in vivo CAR-T成功进入临床阶段,已经一定程度证明了其良好的安全性,并体现出显著的治疗效果。
3. 工艺挑战 & 健新原力in vivo慢病毒平台表现
慢病毒载体in vivo CAR-T细胞疗法在生产工艺上具有诸多优势,但体内注射产品需要严格控制病毒的滴度和纯度,以确保其安全性和有效性,因此在实际工艺开发和生产过程中仍面临一些难点和挑战。
健新原力凭借自身经验,已经成功开发出一套基于悬浮细胞株的生产工艺,获得了高滴度和高纯度的in vivo慢病毒载体产品。目前已经与多家客户达成合作,并已成功交付了一个IIT项目。
挑战一:所需的慢病毒载体滴度高、工艺可放大
In vivo慢病毒载体终端产品的体内注射体积低,因此要求终产品拥有更高的滴度。另外值得关注的问题是,国内绝大多数慢病毒的一期生产仍使用贴壁工艺,无法放大,到后期要完成到第二代工艺变更。
健新原力解决方案
健新原力拥有自主构建高产的质粒骨架,以及DMF备案的慢病毒载体辅助质粒体系,在保证上清滴度达到需求水平的条件下,优化下游纯化工艺,保证终产品满足高滴度、低剂量回输的需求。
另外健新原力自主开发了悬浮生产细胞株InnoS-293T™,已经可以实现25L规模的悬浮生产,同时也满足后期的生产放大需求。
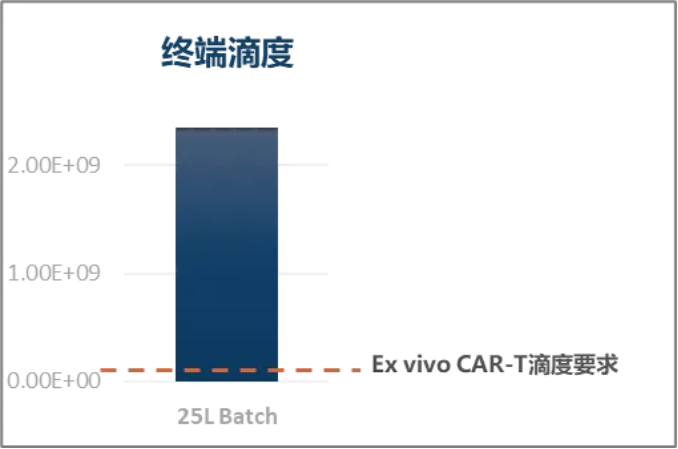
25L平台工艺生物滴度超过行业水平
挑战二:终端过滤的回收率问题
在获得高滴度病毒载体时,滴度越高最终除菌过滤的病毒载体损失越多,进而导致单步收率及总收率非常低。为解决这个问题,目前行业普遍采用前置除菌过滤,但这将导致不溶性微粒水平极难达标,且无菌操作合规性不易实现,后期商业化合规困难。
健新原力解决方案
健新原力已经可以稳定采用终端无菌过滤,并能实现在超高滴度下30%的总回收率。这完美解决了后期合规问题,同时保障了产品回收率。
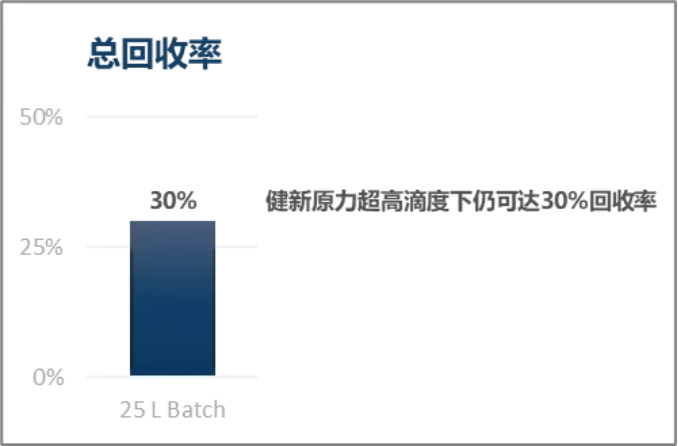
终端除菌过滤工艺慢病毒终回收率
挑战三:杂质控制问题
由于病毒对剪切力比较敏感,且上游采用悬浮培养方式,使得慢病毒载体的下游纯化工艺较难,导致杂质水平高。而相较于体外的应用,in vivo慢病毒载体的安全性要求更高,因此对于杂质的控制会更严格,包括对其HCP(宿主残留蛋白)、 HCD(宿主残留DNA)、不溶性颗粒物以及内毒素残留等的控制,这需要更先进的纯化技术和更严格的质控标准。
健新原力解决方案
健新原力的整个工艺在克服剪切力影响的同时,严格控制杂质残留,包括HCD、HCP等指标均远低于严格控制水平。保证终产品的高纯度、低残留,从而为临床应用提供了强有力的安全保障,确保患者能够安全有效地接受治疗。
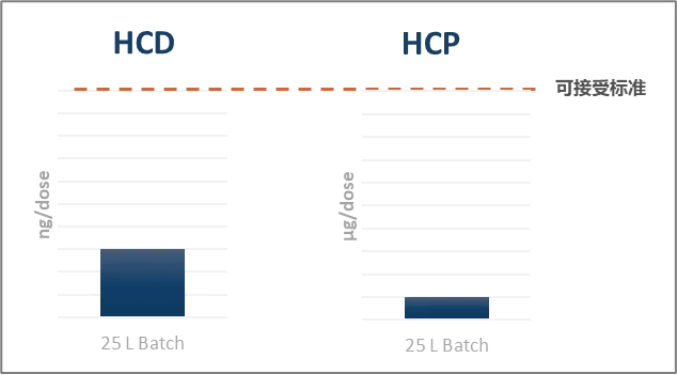
杂质残留远低于可接受标准
In vivo CAR-T疗法是CAR-T领域发展的重要方向,它在降低CAR-T成本,扩大细胞治疗商业化可及性方面具有重要突破。核心的in vivo慢病毒载体技术已获得临床验证,2例血液瘤IIT数据展现出良好的疗效和安全性。此外,基于慢病毒的in vivo疗法也为更多癌症类型和自免疾病的治疗提供了潜在解决方案,吸引了众多科研团队和企业的研发和探索。In vivo慢病毒载体疗法无疑引领着整个生物医药行业朝着更高效、更精准的治疗方向发展,我们也共同期待 “体内时代”的到来!
中文 


健新原力
Topping 